高二化學(xué)重難點(diǎn)化學(xué)反應(yīng)與能量變化
高二化學(xué)重難點(diǎn)化學(xué)反應(yīng)與能量變化
熟練掌握了重難點(diǎn)和考點(diǎn)的方法,融會貫通到其他題目,一定可以順利解決所有的題目,小編在這里整理了高二化學(xué)重難點(diǎn),希望能幫助到大家。
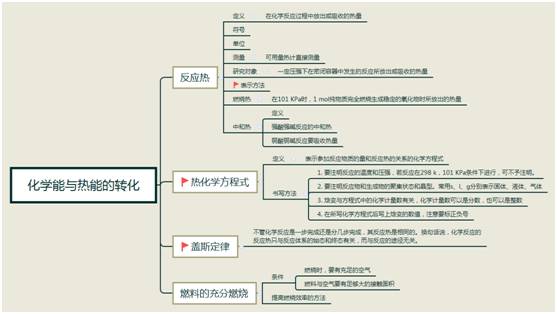
化學(xué)反應(yīng)與能量變化
【重點(diǎn)】
1.蓋斯定律
2.熱化學(xué)方程式的書寫
1)1個(gè)意義
熱化學(xué)方程式不僅表示了化學(xué)反應(yīng)中的物質(zhì)變化,而且也表明了化學(xué)反應(yīng)中的能量變化。
2)4個(gè)書寫熱化學(xué)方程式的注意事項(xiàng)
② 的數(shù)值、符號及單位。
③ 系數(shù)可以是整數(shù)也可以是分?jǐn)?shù)。
④ 若系數(shù)加倍,則 的數(shù)值也加倍,若反應(yīng)逆向,則 改變符號,但絕對值不變。
【難點(diǎn)】
熱化學(xué)方程式的書寫
電解池、原電池
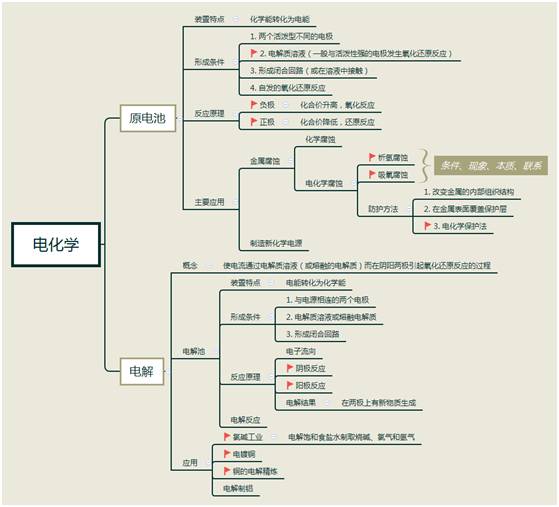
【重點(diǎn)】
1. 原電池的工作原理及電極方程式的書寫。
2. 電解池的工作原理及電極方程式的書寫。
3. 電解池的應(yīng)用。
(1)電解飽和食鹽水以制造燒堿、氯氣和氫氣
1)電鍍應(yīng)用電解原理在某些金屬表面鍍上一薄層其他金屬或合金的方法
2)電極、電解質(zhì)溶液的選擇:
陽極:鍍層金屬,失去電子,成為離子進(jìn)入溶液 ;
陰極:待鍍金屬(鍍件):溶液中的金屬離子得到電子,成為金屬原子,附著在金屬表面
電解質(zhì)溶液:含有鍍層金屬離子的溶液做電鍍液
鍍銅反應(yīng)原理: 陽極(純銅): ,陰極(鍍件):
電解液:可溶性銅鹽溶液,如 溶液
電鍍應(yīng)用之一:銅的精煉: 陽極:粗銅;陰極: 純銅電解質(zhì)溶液: 硫酸銅
4. 金屬的腐蝕和防護(hù)。
【難點(diǎn)】
1. 電解池電極方程式的書寫。
1)陽離子放電順序:
(指酸電離的)
(指水電離的)
2)陰離子放電順序:
① 惰性電極:
② 活性電極:電極本身溶解放電
注意先要看電極材料,是惰性電極還是活性電極,若陽極材料為活性電極(Fe、Cu)等金屬,則陽極反應(yīng)為電極材料失去電子,變成離子進(jìn)入溶液;若為惰性材料,則根據(jù)陰陽離子的放電順序,依據(jù)陽氧陰還的規(guī)律來書寫電極反應(yīng)式。
2. 電解質(zhì)水溶液電解產(chǎn)物的規(guī)律
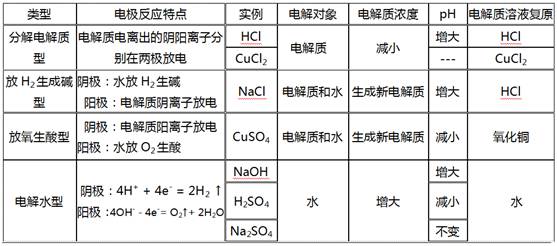
上述四種類型電解質(zhì)分類:
1)電解水型:含氧酸,強(qiáng)堿,活潑金屬含氧酸鹽
2)電解電解質(zhì)型:無氧酸,不活潑金屬的無氧酸鹽(氟化物除外)
3)放氫生堿型:活潑金屬的無氧酸鹽
4)放氧生酸型:不活潑金屬的含氧酸鹽
3. 燃料電池電極方程式的書寫技巧
1)電池的負(fù)極一定是可燃性氣體,失電子,元素化合價(jià)升高,發(fā)生氧化反應(yīng),電池的正極一定是助燃性氣體,得電子,化合價(jià)降低發(fā)生還原反應(yīng)。
2)燃料電池兩電極材料一般都不參加反應(yīng),反應(yīng)的是通到電機(jī)上的燃料和氧氣,兩電極只是傳導(dǎo)電子的作用。
3)電極反應(yīng)做為一種特殊的離子反應(yīng)方程式,也必須遵循原子守恒得失電子守恒電荷守恒
4)寫電極反應(yīng)時(shí)一定要注意電解質(zhì)是什么?其中,離子要和電極反應(yīng)中出現(xiàn)的離子相對應(yīng),在堿性電解質(zhì)中電極反應(yīng)式不能出現(xiàn)氫離子在酸性電解質(zhì)溶液中,電極反應(yīng)式不能出現(xiàn)氫氧根離子
5)正負(fù)極的電極反應(yīng)是在得失電子守恒的條件下,疊加后的電池反應(yīng)必須是燃料燃燒反應(yīng)和燃料產(chǎn)物與電解質(zhì)溶液反應(yīng)的疊加反應(yīng)式。
出現(xiàn)頻率較高的甲烷燃料電池:
(1)堿性介質(zhì) 負(fù)極:
正極:
總反應(yīng):
(2)酸性介質(zhì) 負(fù)極:
正極:
總反應(yīng):
化學(xué)反應(yīng)的方向、限度與速率
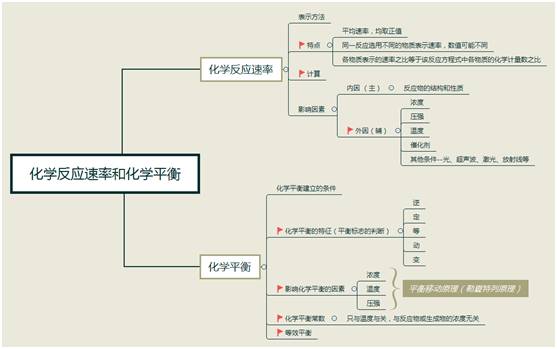
【重點(diǎn)】
1. 化學(xué)平衡概念的理解
可逆反應(yīng)有限度,所有轉(zhuǎn)化不完全。
正逆速率若相等,化學(xué)平衡狀態(tài)現(xiàn)。
此時(shí)反應(yīng)并未停,特征就是動定變。
2. 化學(xué)平衡狀態(tài)的判斷
逆等動定變平衡,一等二最六一定, 正逆反應(yīng)速相等,轉(zhuǎn)產(chǎn)二率最值衡,
質(zhì)量體積 n分?jǐn)?shù), 濃度溫度色一定, 參數(shù)可變變不變(變量不變), 定達(dá)平衡要記清, 參數(shù)一直不變化, 不可用與斷平衡。
解釋:
“逆等動定變平衡”,是指平衡狀態(tài)有逆、等、動、定、變五個(gè)特征。
“一等”是指反應(yīng)體系中同一反應(yīng)物(或生成物)的正、逆反應(yīng)速率相等即達(dá)平衡狀態(tài)。“
二最”是指轉(zhuǎn)化率、產(chǎn)率達(dá)最大值即達(dá)平衡狀態(tài)。
“六一定”是指體系中各組分的質(zhì)量分?jǐn)?shù)、體積分?jǐn)?shù)、物質(zhì)的量分?jǐn)?shù)、濃度不再變化,或體系的溫度及顏色不再變化即達(dá)平衡狀態(tài)。
“參數(shù)可變到不變,定達(dá)平衡要記清”是指參數(shù)(濃度、溫度、質(zhì)量、壓強(qiáng)、體積、密度等)原為變量,后變?yōu)楹懔浚藭r(shí)可逆反應(yīng)達(dá)平衡狀態(tài)。
“參數(shù)一直不變化,不可用與斷平衡”是指若反應(yīng)過程中參數(shù)始終沒有變化,此參數(shù)不可用于判斷可逆反應(yīng)是否達(dá)平衡狀態(tài)
3. 等效平衡
①“等效平衡”是指在相同條件下的同一可逆反應(yīng)里,建立的兩個(gè)或多個(gè)化學(xué)平衡中,各同種物質(zhì)的百分?jǐn)?shù)相同,這些化學(xué)平衡均屬等效平衡,其核心是“各同種物質(zhì)的百分?jǐn)?shù)相同”。
②“等效平衡”常見的有恒溫恒壓和恒溫恒容兩種情形,其口訣可概括為:等壓比相等;等容量相等,但若系(氣體系數(shù))不變,可為比相等【三種情況前提:等T】。
4. 化學(xué)反應(yīng)速率、平衡轉(zhuǎn)化率、化學(xué)平衡常數(shù)的計(jì)算
【難點(diǎn)】
1. 化學(xué)反應(yīng)速率和化學(xué)平衡圖像
(1)速率與平衡的圖象分析
1) 認(rèn)清坐標(biāo)系,搞清縱、橫坐標(biāo)所代表的意義,并與有關(guān)的原理掛鉤。
2)看清起點(diǎn),分清反應(yīng)物、生成物,濃度減小的是反應(yīng)物,濃度增大的是生成物一般生成物多數(shù)以原點(diǎn)為起點(diǎn)。
3)抓住變化趨勢,分清正、逆反應(yīng)。分清吸、放熱反應(yīng)。分清漸變和突變。升高溫度時(shí),v(吸)>v(放),在速率-時(shí)間圖上,要注意看清曲線是連續(xù)的還是跳躍的。
4)注意終點(diǎn)。例如在濃度-時(shí)間圖上,一定要看清終點(diǎn)時(shí)反應(yīng)物的消耗量、生成物的增加量,并結(jié)合有關(guān)原理進(jìn)行推理判斷。
(2)對于可逆反應(yīng):(正反應(yīng)放熱)
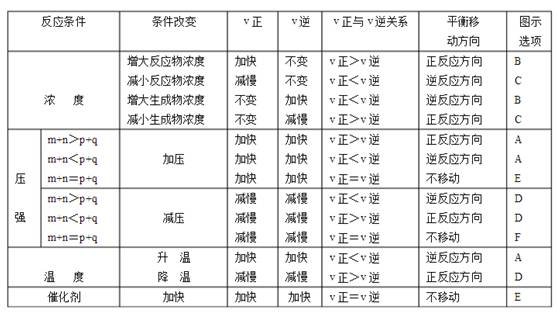
速率與平衡圖像記憶口訣:
濃度: 增濃都增大,減濃都減小,變者為突變,不變?yōu)闈u變;
壓強(qiáng): 增壓都增大,大者變更大,減壓都變小,大者變更小;
溫度: 升溫都變大,吸熱變更大,降溫都變小,吸熱變更小;
催化劑:沒出等增大,阻化等減小,平衡不移動,時(shí)間改變了。
高二化學(xué)重難點(diǎn)化學(xué)反應(yīng)與能量變化相關(guān)文章:
